Perfekte Wasserfilter der Zelle
Das Wasser außerhalb der Zelle wird mit hohem Druck durch die Wasserkanäle gepresst. In der Mitte ist der Durchmesser 0,3 nm und an den beiden Öffnungen 2 nm. 2 Milliarden Wassermoleküle strömen pro Sekunde durch die Aquaporine.
Kaliumionen werden durchgelassen, Natriumionen bleiben draußen.
Vergleichen Sie das mit einem künstlichen Filter:

Mit der Umkehrosmose wird die Filterung durch die Aquaporine nachgeahmt. Aber da ist keine vergleichbare Geschwindigkeit erreichbar.
Aber folgendes ist wichtig:
Die gesunde menschliche Zelle besitzt gut funktionierende Aquaporine, die nur gereinigtes Wasser mit den notwendigen Funktionsstoffen in das Zellinnere lassen. Werden die Aquaporine geschädigt, dann werden die Zellkraftwerke erlöschen. Die Zelle wird sterben.
Wasser reguliert alle Lebensfunktionen!
w.st. 2014-01-25
http://de.wikipedia.org/wiki/Exozytose
Exozytose ist eine Art des Stofftransports aus der Zelle heraus.)
Perfekte Wasserfilter der Zelle
Das Wasser außerhalb der Zelle wird mit hohem Druck durch die Wasserkanäle gepresst. In der Mitte ist der Durchmesser 0,3 nm und an den beiden Öffnungen 2 nm. 2 Milliarden Wassermoleküle strömen pro Sekunde durch die Aquaporine.
Vergleichen Sie das mit einem künstlichen Filter:

Mit der Umkehrosmose wird die Filterung durch die Aquaporine nachgeahmt. Aber da ist keine vergleichbare Geschwindigkeit erreichbar.
Aber folgendes ist wichtig: Die gesunde menschliche Zelle besitzt gut funktionierende Aquaporine, die nur gereinigtes Wasser in das Zellinnere lassen. Gleichzeitig gelangen mit dem Wasser physikalische gelöste Stoffe ( einige Mineralien und Gase) in den Zellinnenraum.
Kaliumionen werden durchgelassen, Natriumionen werden blockiert.
Die Computersimulationen offenbaren einen faszinierenden, fein-choreographierten ’Tanz der Wassermoleküle’, der durch einzelne, genauestens in der Innenseite des Kanals positionierte Proteinbausteine (Aminosäuren) gesteuert wird. Diese präzise Steuerung der Bewegung der Wassermoleküle hat, wie sich zeigte, zwei Funktionen:
Zum einen werden dadurch die Wassermoleküle auf ihrem Weg durch den Kanal geordnet ’weitergereicht’, was ihre Durchflussrate drastisch erhöht.
Zum anderen werden Wasserstoffbrückenbindungen zwischen den durchtretenden Wassermolekülen kurzfristig gelöst und dadurch der Durchfluss von Protonen blockiert. Das Aufbrechen dieser Bindungen erfordert normalerweise den Einsatz einer beträchtlichen Energiemenge (weshalb Wasser erst bei 100°C kocht, Kohlendioxid dagegen schon bei -78°C). Das Aquaporin kompensiert diesen Energieaufwand, indem einzelne seiner Aminosäuren mit den vorbeifließenden Wassermolekülen sehr gezielt Wasserstoffbrückenbindungen ausbilden. Auch diese Brückenbildung ist nur möglich durch das präzise Ausrichten und Weiterreichen der Wassermoleküle. Die Wasserleitung durch Aquaporin erweist sich als spektakuläres Beispiel, welch raffinierte molekulare Nanotechnik die Natur über Jahrmillionen entwickelt hat.
Werden die Aquaporine geschädigt, dann werden die Zellkraftwerke langsam wirkungslos. Die Zelle wird sterben.
http://flexikon.doccheck.com/de/Aquaporin
Einteilung
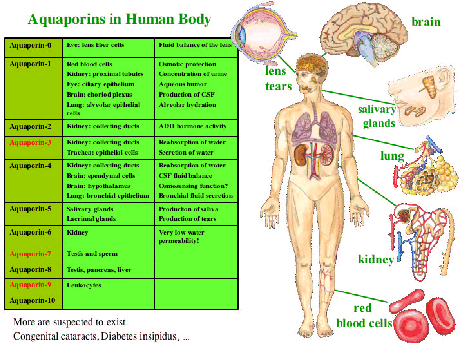
Insgesamt sind über 10 verschiedene Aquaporine bekannt, von denen mindestens 6 in der Nierelokalisiert sind. Sie werden systematisch durchnummeriert. Die am besten erforschten Aquaporine sind Aquaporin 1, 2, 3 und 4.
Funktion
Durch die Größe der Pore sind Aquaporin-Proteine nur durchlässig für kleine Moleküle, vor allem H2O. Allerdings ist bis jetzt nicht klar verstanden, wie Aquaporine zwischen Wassermolekülen und den in der Größe etwa gleichen Hydronium-Ionen trennen können. Dies ist wichtig, um die Diffusion von Wasser bei gleichzeitigem Zurückhalten von Ladungsträgern zu ermöglichen; außerdem ermöglicht die Selektvität der Aquaporine den Aufbau eines pH-Gradienten über eineMembran.
Ein Aquaporin-Molekül ist in der Lage, pro
Sekunde bis zu 3 x 109 Wassermoleküle durch
erleichterte Diffusion passieren zu lassen. Eine besondere Rolle kommt hierbei dem Aquaporin 2 zu, das als einziges Aquaporin durch ADH kontrolliert wird. Eine erhöhte Konzentration von ADH führt zu einer verstärkten Translation von Aquaporin 2 und zur Verschmelzung des in Vesikeln vorliegenden Proteins mit der apikalen Membran. So wird bei Hypovolämie mehr Wasser im Sammelrohr rückresorbiert und ans Blut abgegeben (Gauer-Henry-Reflex).
http://thomaspfluger.de/blog/?p=4865
08.08.2013
Ohne Löcher gäbe es kein Leben.
Während
zum Beispiel ein Luftballon seine Funktion nur erfüllt, wenn er absolut dicht
ist, muß die Zelle durchlässig sein.
Zellen sind von einer
für Wasser undurchlässigen
Doppelmembran umgeben.
Daß es Löcher geben müsse, durch die der
Lebenssaft in das Innere der Zelle gelangt, haben deutsche Forscher schon im
19. Jahrhundert postuliert. Berühmt geworden sind etwa die Versuche von Wilhelm
Pfeffer im Jahr 1877, mit denen die sogenannte Osmose demonstriert
wurde.
Bei der Osmose
strömt Wasser durch eine feinporige Membran, während anderen Stoffen die
Passage verwehrt bleibt. Die Osmose ist zum Beispiel der Grund dafür, daß sich
eine welke Pflanze wieder aufrichten kann.
In jeder Zelle herrscht ein ständiges
Kommen und Gehen. Ein Haufen Proteine, verpackt in einem Lipidsack – so
könnte man sich auf den ersten Blick eine Zelle vorstellen. Doch Zellmembranen
sind weit mehr als eine schlichte Hülle: Sie entscheiden, wer in die Zelle
hinein und wer sie verlassen darf.
In der Zelle herrscht
ein ständiges Kommen und Gehen. Damit alles in seinen geordneten Bahnen
verläuft, besitzt die Zellmembran Kanalproteine ,
die nur bestimmte Substanzen – wie Wasser oder Ionen – passieren lassen.
Die Strukturaufklärung dieser fundamentalen Kanäle bescherte zwei Amerikanern ,
Peter Agre und Roderick McKinnon 2003 den Chemie-Nobelpreis.
Die Strukturaufklärung dieser
fundamentalen Kanäle bescherte zwei Amerikanern 2003 den Chemie-Nobelpreis.
Aquaporine:
Die Wasserkanäle für die Zellen
In
Computersimulationen ist es gelungen den Verlauf der Wassermoleküle durch die
Zellmembran darzustellen und die Funktionsweise zu verstehen. Dabei spielen
Aquaporine eine entscheidende Rolle. Aquaporine sind Proteine. Diese bilden
einen Kanal durch die sonst absolut undurchlässige Membran der Zelle.
Gleichzeitig sind diese Proteine zuständig dafür, dass Zellen auf Grund des osmotischen Drucks
keinen Schaden nehmen. Aquaporine kommen gleichermaßen beim Menschen, Pflanzen
und Tieren vor.

Aquaporine-Modell nach Peter Agre
Aquaporine sind der
Wasserspringbrunnen der
Zelle. Die Proteine sind beim Menschen 2
Nanometer lang
und nur 0,3 Nanometer im
Durchmesser. Bis zu 3 Mrd. Wassermolekühle
können
durch eine „Wasserleitung“ pro Sekunde
durchfließen. Eine erstaunliche
Leistung. Nimmt
man eine Vielzahl Aquaporine Kanäle zusammen,
kann der Körper
damit Literweise Wasser im
Sekundentakt transportieren. Wer Wasserfilter
kennt,
weiß am Besten was diese Durchflussmenge
für eine Leistung ist.
In den Jahren 2000 und 2001 gelang es
Agre und anderen Forschern, die molekulare Feinstruktur von Aquaporinen zu
entschlüsseln. Das Protein besitzt in der Mitte einen gewundenen Kanal. Die
Atome an dessen Wänden erzeugen ein elektrisches Feld. Elektrisch neutrale
Wassermoleküle können durch die Pore schlüpfen, positiv geladene Protonen
indessen werden zurückgehalten. Könnten Protonen ebenfalls ungehindert
passieren, wäre das für die Zelle tödlich. Welch immense Bedeutung Aquaporinen
zukommt, läßt sich an der Niere veranschaulichen. Pro Tag entstehen dort bei
einem Erwachsenen rund 170 Liter Primärurin. Zwei Sorten von Aquaporinen sorgen
dafür, daß der größte Teil des Wassers im Körper verbleibt. Ausgeschieden wird
nur rund ein Liter Urin.
Durchbruch dank
MacKinnon
Zellen tauschen mit ihrer Umgebung eine
Fülle von Stoffen aus. Dazu gehören elektrisch geladene Teilchen (Ionen), denen
entscheidende Bedeutung etwa für die Kommunikation von Nervenzellen zukommt.
Schon 1890 postulierte Wilhelm Ostwald, daß die in Gewebe auftretenden
elektrischen Ströme von Ionen hervorgerufen werden, die durch Zellmembranen
wandern. Von der Mitte des vergangenen Jahrhunderts an wurde dieser
Ionentransport immer genauer studiert. Es zeigte sich, daß Nervenimpulse vor
allem auf der Passage von Kalium- und Natriumionen beruhen. Man kam zu dem
Schluß, daß es Poren geben müsse, die durchlässig für Kaliumionen, aber
undurchlässig für Natriumionen sind. Wie das möglich sein sollte, blieb
zunächst rätselhaft, denn Natriumionen sind kleiner als Kaliumionen. Sie
sollten daher eigentlich durch die Kaliumionenkanäle schlüpfen können.

Den Forschern war klar, daß sich das
Rätsel nur anhand der genauen Struktur der Kanäle lösen lassen würde. Der Durchbruch bei der Strukturanalyse gelang Roderick
McKinnon im Jahr 1998. Er konnte die Architektur eines Kaliumionenkanals aus
Bakterien in atomarer Auflösung präsentieren. Nun wurde erklärbar, wie fremde
Ionen abgehalten werden. Wenn sich Ionen der Eintrittspforte nähern, sind sie
von Wassermolekülen umgeben. Passieren können sie aber nur “nackt”. Die
entscheidende Rolle spielen Sauerstoffatome in der Wand des Kanals. Der Abstand
zwischen ihnen und den Kaliumionen ist genauso groß wie der Abstand zwischen
den Sauerstoffatomen des Wassers und den gelösten Kaliumionen. Daher können
Kaliumionen unbehelligt durchschlüpfen. Natriumionen indessen passen nicht in
dieses Muster und werden zurückgehalten.
Quellen
Peter Agre – Roderick McKinnon
, The Nobel Prize in Chemistry 2003
” for the discovery of water
channels in cell membranes”

© THE NOBEL FOUNDATION
Nobelpreisträger Peter Agre und Roderick McKinnon
Nobelpreisträger Peter Agre und Roderick McKinnon
- See more at:
http://thomaspfluger.de/blog/?p=4865#sthash.o5jwUmya.dpuf










http://www.innovations-report.de/html/berichte/biowissenschaften_chemie/bericht-6624.html?
Max-Planck-Wissenschaftler entschlüsseln die Nanomechanik von
Aquaporinen, mikrofeinen Wasserkanälen in der Zellmembran
Wasser ist für die Funktion von Zellen und Organen im menschlichen
Körper von zentraler Bedeutung. Der Wassertransport zwischen den
Zellen erfolgt über in die Zellmembran eingebettete mikrofeine Kanäle,
den so genannten Aquaporinen. Wissenschaftlern vom Max-Planck-
Institut für biophysikalische Chemie in Göttingen ist es jetzt gelungen, den
genauen Funktionsmechanismus dieser perfekten Wasserfilter mit Hilfe
umfangreicher Computersimulationen bis in atomare Details aufzuklären
(Science, 14. Dezember 2001).
Aquaporine sind Proteine, die einen wasserleitenden Kanal durch die Zellwand formen; sie finden sich in der ansonsten wasserundurchlässigen Zellmembran vieler Pflanzen und Tiere und verhindern, dass die Zellen zum Beispiel bei einer Änderung der Salzkonzentration in der Umgebung platzen (osmotische Regulierung). Beim Menschen regulieren Aquaporine u.a. den Wasserhaushalt in der Niere, in den roten Blutkörperchen, in der Augenlinse und im Gehirn. Ein Defekt oder eine Fehlfunktion dieser Proteine löst Krankheiten aus, wie Diabetes insipidus, den grauen Star (Katarakt) oder einen neuronal verursachten Gehörverlust.
In allen Fällen ist ein hocheffizienter, aber selektiver Wassertransport von zentraler Bedeutung, der den Austausch anderer Moleküle ausschließt. So lassen die Aquaporine zwar Wassermoleküle hindurch, verhindern aber, dass die Zelle Nährstoffmoleküle oder Salz-Ionen verliert. Obwohl diese Filter sehr feinporig sind, erreichen Aquaporine eine erstaunlich hohe Wasserleitfähigkeit von bis zu drei Milliarden Wassermolekülen pro Sekunde und Kanal. Eine 10x10 cm2 große Membran mit eingebetteten Aquaporinen könnte somit etwa einen Liter Wasser in ca. 7 Sekunden filtern oder entsalzen.
Wie aber erfüllt das Protein diese widerstreitenden Anforderungen? Erste Antworten ergaben sich bereits aus der räumlichen Atomstruktur des Aquaporins (AQP1), die erst vor kurzem in enger Zusammenarbeit zwischen einer japanischen Arbeitsgruppe um Yoshinori Fujiyoshi, einer Baseler Gruppe um Andreas Engel und der Göttinger Max-Planck-Arbeitsgruppe "Theoretische Molekulare Biophysik" mit Hilfe elektronenmikroskopischer Messungen entschlüsselt wurde. Es zeigte sich, dass das Protein in der Zellmembran einen zwei Nanometer (zwei Millionstel Millimeter) langen und an der engsten Stelle nur 0,3 Nanometer breiten Kanal bildet - gerade groß genug, um ein einzelnes Wassermolekül passieren zu lassen. Diese Enge können größere Moleküle gar nicht erst passieren.
Die Evolution hat darüber hinaus aber auch eine Antwort auf die Frage gefunden, wie sich in einem solchen Kanal der Durchfluss kleinerer Ionen blockieren lässt. Lebenswichtig ist es vor allem, den Durchfluss von Protonen (Wasserstoff-Ionen) zu unterbinden, damit eine unterschiedliche Protonenkonzentration (pH-Wert) zwischen dem Innern und dem Äußeren der Zelle als wichtiger Kurzzeit-Energiespeicher aufrechterhalten werden kann. Ähnlich einer elektrischen Batterie würde dieser Speicher bei Durchfluss von Protonen kurzgeschlossen und entladen.
Nun ist Wasser selbst ein relativ guter Protonenleiter; die Protonen springen dort sehr schnell über so genannte Wasserstoffbrücken von Wassermolekül zu Wassermolekül. Wie also verhindert Aquaporin, dass sich der Protonenfluss auch durch den Membrankanal fortsetzt? Über die Antwort auf diese Frage konnte man bisher auf der Grundlage der statischen räumlichen Struktur des Wasserkanalproteins nur spekulieren. Vor allem war es nicht möglich, die Bewegung der Wassermoleküle durch den Kanal zu beobachten. Damit blieb auch unklar, wie die außerordentlich hohe Durchflussgeschwindigkeit des Wassers zustande kommt.
 | |
"Abb. 1: Für die durchgeführten Simulationen verwendetes Computermodell des Aquapo-rin/Membran-Systems. Die biologisch aktive Form von Aquaporin ist ein Tetramer, ein aus vier Aquaporin-Molekülen bestehender Komplex (orange/cyan/magenta/blau), der in die Zellmembran (grün/gelb) eingelagert ist. Auf der Innen- und Außenseite der Membran wurde flüssiges Wasser (rot/weiß) simuliert, das durch die vier Aquaporin-Moleküle hindurchtritt. Das Gesamtsystem umfasste ca. 100.000 Atome." "Grafik: Max-Planck-Institut für biophysikalische Chemie"
|
Den Wissenschaftlern vom Max-Planck-Institut für biophysikalische Chemie gelang es nun, die Bewegung einzelner Wassermoleküle durch einen Aquaporin-Kanal mit Hilfe atomar aufgelöster Computersimulationen im Detail und ’in Echtzeit’ zu verfolgen. Für diese Simulationen haben die Wissenschaftler das Protein im Computer Atom für Atom ’nachgebaut’ (s. Abb. 1), in eine Membran eingebettet und mit einer großen Zahl von Wassermolekülen umgeben, so dass sich das virtuelle Protein quasi in seiner natürlichen Umgebung befand. Insgesamt umfasste das Modell etwa 100.000 Atome, deren Bewegungen in einer anschließenden so genannten Molekulardynamik-Simulation akkurat berechnet wurde. Für die Simulation waren mehrere Monate Rechenzeit auf einem aus 80 Prozessoren bestehenden Hochleistungsparallelrechner erforderlich. Entstanden ist eine Filmsequenz, in der jedes Detail der Bewegung einzelner Wassermoleküle am Bildschirm betrachtet und analysiert werden kann (s. Abb. 2). Auch die Durchflussgeschwindigkeit des Wassers wurde durch die Simulation korrekt wiedergegeben, ein wichtiger Test für die Richtigkeit der Rechnung.
 | |
"Abb. 2: Schnappschuss des Aquaporins während der Simulation. Links: Wassermoleküle (rot/weiß) diffundieren über Aquaporin (blau) durch die Zellmembran (gelb/grün). Der Ausschnitt rechts zeigt den ‚Tanz’ eines einzelnen Wassermoleküls auf seinem Weg durch den Kanal." "Grafik: Max-Planck-Institut für biophysikalische Chemie"
|
Die Computersimulationen offenbaren einen faszinierenden, fein-choreographierten ’Tanz der Wassermoleküle’, der durch einzelne, genauestens in der Innenseite des Kanals positionierte Proteinbausteine (Aminosäuren) gesteuert wird. Diese präzise Steuerung der Bewegung der Wassermoleküle hat, wie sich zeigte, zwei Funktionen: Zum einen werden dadurch die Wassermoleküle auf ihrem Weg durch den Kanal geordnet ’weitergereicht’, was ihre Durchflussrate drastisch erhöht. Zum anderen werden Wasserstoffbrückenbindungen zwischen den durchtretenden Wassermolekülen kurzfristig gelöst und dadurch der Durchfluss von Protonen blockiert. Das Aufbrechen dieser Bindungen erfordert normalerweise den Einsatz einer beträchtlichen Energiemenge (weshalb Wasser erst bei 100°C kocht, Kohlendioxid dagegen schon bei -78°C). Das Aquaporin kompensiert diesen Energieaufwand, indem einzelne seiner Aminosäuren mit den vorbeifließenden Wassermolekülen sehr gezielt Wasserstoffbrückenbindungen ausbilden. Auch diese Brückenbildung ist nur möglich durch das präzise Ausrichten und Weiterreichen der Wassermoleküle. Die Wasserleitung durch Aquaporin erweist sich als spektakuläres Beispiel, welch raffinierte molekulare Nanotechnik die Natur über Jahrmillionen entwickelt hat.
In weiteren Arbeiten möchte die Göttinger Arbeitsgruppe im Rahmen eines von der Europäischen Union geförderten internationalen Projekts versuchen, jene Moleküle zu konstruieren und in der Simulation zu testen, die den Wasserfluss durch das Aquaporin regulieren oder sogar blockieren können. Die genaue Kenntnis solcher Substanzen würde u.a. vielversprechende Ansatzpunkte für die Entwicklung neuer Medikamente liefern.
Computersimulationen von Proteinen auf atomarer Ebene werden in jüngster Zeit mit wachsendem Erfolg durchgeführt, nicht zuletzt dank rasch wachsender Rechnerleistung. Über die traditionelle Bioinformatik hinausgehend, ermöglichen solche Simulationen ein tiefgehendes physikalisch-chemisches Verständnis grundlegender biologischer Prozesse.
Dr. Helmut Grubmüller | Quelle: Presseinformation
Weitere Berichte zu: Aquaporin > Atom > Durchfluss > Kanal> Protein > Simulation > Wassermolekül > Zelle > Zellmembran
Weitere Nachrichten aus der Kategorie Biowissenschaften Chemie:
24.01.2014 | Fraunhofer-Institut für Bauphysik
24.01.2014 | Universität zu Lübeck

Keine Kommentare:
Kommentar veröffentlichen